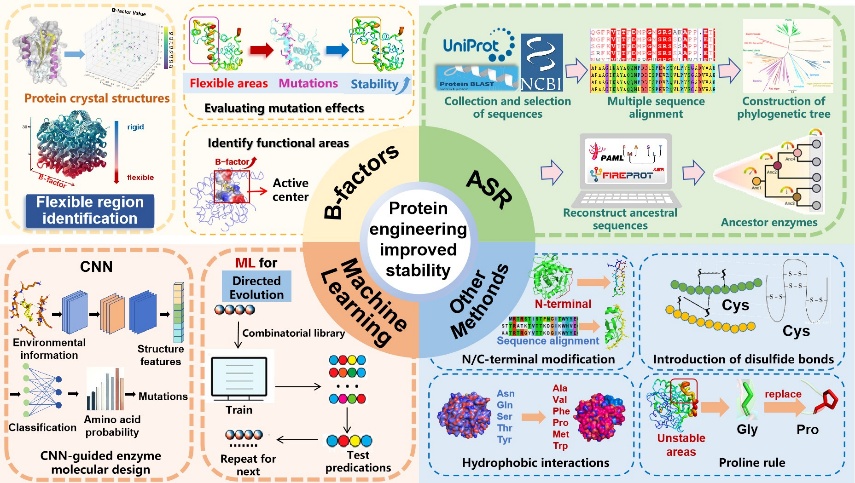
酶的稳定性改造在酶工程中具有至关重要的意义。天然酶在极端条件(如高温、有机溶剂或极端pH值)下易失活,限制了其在工业中的应用。通过引入氢键、盐桥、二硫键、脯氨酸插入、减少表面疏水性以及N端和C端工程等传统方法,可以显著增强酶的稳定性,使其更耐受工业环境中的苛刻条件。近年来,结合先进计算技术和新兴方法(如B因子分析、祖先酶重建和机器学习,图1)的稳定性改造获得了飞速发展,提高了酶在复杂工业条件下的催化效率,且推动了酶在生物催化、制药、食品工业和生物燃料等领域的广泛应用。
2025年3月,山西大学杨恒权团队联合中国科学院天津工业生物技术研究所孙周通/袁波在BioDesign Research发表题为Recent advances on protein engineering for improved stability的综述性论文。
本文系统总结了近年来提升酶热稳定性的策略,探讨了相关方法在酶工程中的应用及其未来前景。B因子表征蛋白质晶体中原子热运动,与稳定性密切相关。B-FIT等方法可用于分析酶的柔性区域并优化突变。祖先序列重建(Ancestral Sequence Reconstruction,ASR)反映了早期蛋白质适应极端环境的特性,可用于推断已灭绝物种的祖先酶序列。部分祖先酶无需进一步改造即具备优良性能,并可作为定向进化的起点,同时用于识别提升热稳定性的突变位点。机器学习方法(Machine Learning, ML)通过数据分析预测未表征蛋白质特性,目前成为了酶设计的核心工具。ML可从随机诱变数据中提取价值,加速进化过程,深度学习中的卷积神经网络(Convolutional Neural Network,CNN)因擅长空间层次识别,尤其适用于蛋白质结构分析。当前的酶工程领域正从单一策略向多层面方法转型,未来多种方法的协同将成为酶工程领域的常态。
该工作得到国家重点研发计划、国家自然科学基金、天津市合成生物技术创新能力提升行动的资助。山西大学与中国科学院天津工业生物技术研究所联合培养博士研究生时静豪为该论文第一作者,杨恒权教授、孙周通研究员、袁波副研究员为该论文共同通讯作者。